Calor
El calor es el proceso a través del cual se transfiere energía térmica entre los cuerpos. En este apartado estudiaremos
- Qué es el calor
- Cómo se relaciona el calor con el cambio de temperatura a través de:
- Cómo se relaciona el calor con los cambios en el estado de agregación
- Qué ocurre cuando dos cuerpos a distinta temperatura se ponen en contacto
- Los mecanismos de propagación del calor
Concepto de calor
Las partículas de los cuerpos no están en reposo sino que se encuentran en constante agitación. Como consecuencia de esta agitación, los cuerpos poseen una determinada energía térmica. La temperatura es un indicador de la energía térmica que tienen los cuerpos. De modo general podemos decir que, a mayor temperatura, mayor energía de este tipo. Pues bien, los cuerpos y los sistemas pueden intercambiar energía térmica. A esta energía térmica intercambiada se le denomina calor. En ocasiones también se denomina calor al propio proceso de transferencia de energía.
El calor es la energía intercambiada entre un cuerpo y su entorno por el hecho de encontrarse a distinta temperatura. El calor, como el trabajo, es energía en tránsito, por lo que se puede entender también como un método para transferir energía.
¿Es lo mismo calor que temperatura?
No, calor y temperatura no son la misma cosa. Es muy posible que esta idea te parezca extraña porque cotidianamente la solemos confundir. Sin embargo te proponemos el siguiente experimento.
- Llena dos ollas de agua, una con la mitad o la tercera parte de agua que la otra
- Ponlas ambas sobre una llama de igual intensidad. Anota el tiempo que tarda cada una de ellas en empezar a hervir
- Mide la temperatura de cada una en el momento en que empiezan a hervir
Si lo haces comprobarás que:
- La que tiene menos agua empieza a hervir antes, o lo que es lo mismo, ha necesitado menos energía para llegar al punto de ebullición.
- Si mides la temperatura al comenzar a hervir en los dos casos, ambas temperaturas son iguales (en torno a 100 ºC).
Esto es debido a que el fuego transfiere energía a la olla y esta a su vez al agua. A esa energía transmitida la conocemos como calor. En la que tiene menos agua se ha empleado menos calor para llegar a la misma temperatura. Por ende, temperatura y calor no son la misma cosa.

Capacidad calorífica
Cuando colocas aceite en una sartén y enciendes el fuego, el aceite comenzará a aumentar su temperatura. En general, cuando suministramos calor a un cuerpo este puede aumentar su temperatura.
La capacidad calorífica de un cuerpo es la relación que hay entre el calor suministrado al cuerpo y su incremento de temperatura. Se puede calcular a través de la expresión:
Donde:
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
Puedes entender la capacidad calorífica como la dificultad con que un cuerpo aumenta su temperatura cuando le suministramos una determinada cantidad de calor. Así, a mayor capacidad calorífica, menor incremento de temperatura para una determinada cantidad de calor suministrado. Los aislantes térmicos tienen una capacida calorífica alta.
¿De qué depende la capacidad calorífica?
La capacidad calorífica de un cuerpo depende de dos factores:
- La sustancia por la que está formado el cuerpo: No aumentan su temperatura de igual manera un gramo de agua que un gramo de aceite o un gramo de hierro, aún cuando se sitúen sobre un fuego de igual intensidad: El hierro sería el primero en aumentar su temperatura, seguido del aceite y finalmente el agua
- La cantidad de masa del cuerpo: Tal y como has podido comprobar en el experimento anterior, no aumenta su temperatura de igual manera un gramo y un kilogramo de agua, aún cuando se sitúen sobre un fuego de igual intensidad: un gramo de agua variará su temperatura más rapidamente que un kilogramo de esta misma sustancia
Estos dos factores nos permiten definir el calor específico de una sustancia.
Calor específico
El calor específico se obtiene a partir de la capacidad calorífica y representa la dificultad con que una sustancia intercambia calor con el entorno. Es una característica de las sustancias que forman los cuerpos y es independiente de la masa.
El calor específico de una sustancia es su capacidad calorífica por unidad de masa. Viene dada por la expresión:
Donde:
- c : Calor específico. Es la cantidad de calor que la unidad de masa de la sustancia tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC )
- C : Capacidad calorífica. Es la cantidad de calor que el cuerpo tiene que intercambiar con su entorno para que su temperatura varíe un kelvin. Su unidad de medida en el Sistema Internacional es el julio por kelvín ( J/K ), aunque también se usa con frecuencia la caloría por grado centígrado ( cal/ºC )
- m: Masa. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
Calor específico molar
En ocasiones, particularmente en el caso de sustancias gaseosas, conviene usar el mol como unidad de masa. De esta manera, el calor específico queda referido a la unidad de masa según la expresión:
Donde n en este caso es el número de moles. En cuanto a las unidades de medida del calor específico molar, se suele utilizar el J/mol·K aunque también se usa con frecuencia el cal/mol·ºC.
Características del calor específico
Algunas características del calor específico son:
- Cuanto mayor es el calor específico de una sustancia, más calor hay que intercambiar para conseguir variar su temperatura
- Existe un rango de temperaturas dentro del cual el calor específico es constante. Aunque a la hora de resolver los ejercicios de este nivel se considera c constante, en realidad el calor específico de cualquier sustancia varía con la temperatura
- Según si el proceso de intercambio de energía (calor) tiene lugar a presión constante o a volumen constante se habla de calor específico a presión constante cp o calor específico a volumen constante cv. Si no se especifica, el proceso se supone a presión constante de 1 atm
- Normalmente en sólidos y líquidos cp ≈ cv
- Normalmente en gases cp ≠ cv
Ecuación fundamental de la termología
Gracias al concepto de calor específico disponemos de una expresión para determinar el calor agregado o extraido de una sustancia a partir del incremento en su temperatura, su calor específico y la cantidad de masa que tenemos. A esta expresión se la conoce como la ecuación fundamental de la termología.
La ecuación fundamental de la termología establece la relación entre el incremento de temperatura experimentado por una determinada cantidad de sustancia y el calor que intercambia:
Donde:
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- m : Masa. Cantidad de sustancia considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- c : Calor específico. Representa la facilidad que una sustancia tiene para variar su temperatura cuando intercambia calor con el entorno. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC ). Cuando conocemos el número de moles de sustancia en lugar de su peso (nos dan m en moles), podemos usar el calor específico molar que se suele específicar en J/mol·K ó cal/g·ºC
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
Signo del calor
- Si la temperatura aumenta, Tf > Ti ⇒ ∆T > 0 ⇒ Q > 0 ⇒ el calor es positivo, el cuerpo gana energía térmica
- Si la temperatura disminuye, Tf < Ti ⇒ ∆T < 0 ⇒ Q < 0 ⇒ el calor es negativo, el cuerpo pierde energía térmica
Unidades de medida del calor
Las unidades de medida más usadas para el calor son:
- El julio ( J ). Es la unidad del calor en el Sistema Internacional. Las unidades del calor son iguales a las unidades del trabajo ya que ambos son procesos de intercambio de energía
- La caloría ( cal ). Representa la cantidad de energía que hay que suministrar a un gramo de agua para que aumente su temperatura 1 ºC
- 1 cal = 4.184 J
- La kilocarloría ( kcal ). También conocida como caloría grande, en contraposición a la caloría, que se conoce como caloría pequeña. Normalmente se usa en nutrición
- 1 kcal = 1000 cal
- La unidad térmica británica ( BTU ). Representa la cantidad de calor que hay que suministrar a una libra de agua para que aumente su temperatura 1 ºF
- 1 BTU = 252 cal
Calor y cambios de estado de agregación de la materia
Otro efecto del calor sobre los cuerpos, junto con el cambio de temperatura, es el cambio en el estado de agregación de la materia. Recuerda que la materia se encuentra fundamentalmente en uno de estos tres estados de agregación posibles:
- sólido
- líquido
- gaseoso
En los cambios de estado se producen los siguientes fenómenos, relacionados con el calor:
- El cuerpo intercambia calor con su entorno: Si el cuerpo no puede absorber o ceder calor, permanecerá en el mismo estado
- El cambio de estado es un proceso térmicamente reversible, es decir, la cantidad de calor absorbida en la transformación directa ( proceso endotérmico ) es exactamente igual a la cantidad cedida en la transformación inversa ( proceso exotérmico ): Por ejemplo para pasar de hielo a agua líquida se necesita suministrar el mismo calor que se desprende cuando se pasa de agua líquida a hielo.
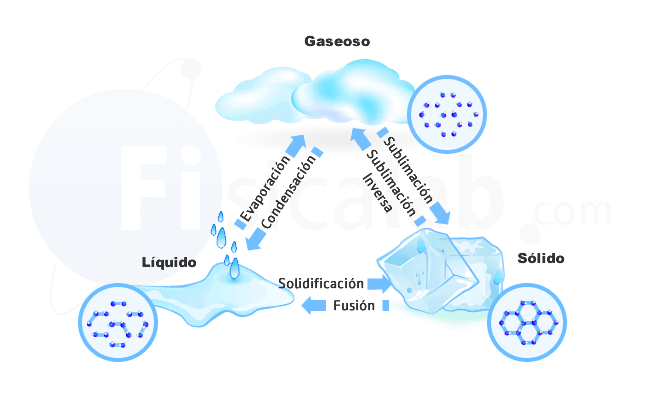
- La temperatura permanece constante: El calor absorbido o cedido se emplea en el cambio de estado y no en variar la temperatura.
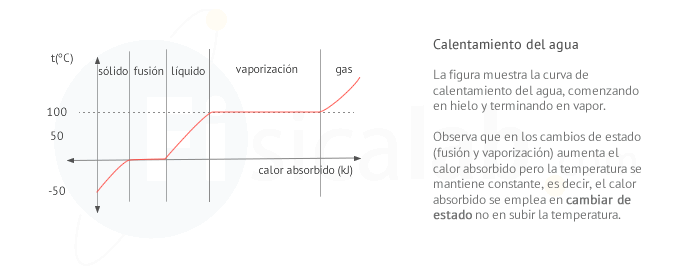
La cantidad de calor absorbida o cedida durante un proceso de cambio de estado viene dada por la expresión:
Donde:
- Q : Calor intercambiado. Cantidad de energía térmica intercambiada con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se usa con frecuencia la caloría ( cal ). 1 cal = 4.184 J
- m: Masa. Cantidad de sustancia considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- L : Variación de entalpía o calor latente. Es la cantidad de calor por unidad de masa necesaria para realizar el cambio de estado. Su unidad de medida en el Sistema Internacional es el julio por kilogramo ( J/kg ) aunque también se suele usar la caloría por gramo ( cal/g )
La variación de entalpía o calor latente L es una característica de cada sustancia para cada cambio de estado. Así, por ejemplo, la fusión de 1 gramo de hielo a 0 ºC y a 1 atm consume 335 J de calor, por lo que Lfusión = 335 J/kg . Como puedes suponer, cuando 1 gramo de agua a 0 ºC y a 1 atm se convierte en hielo, se liberan exactamente 335 J.
Equilibrio térmico
Cuando dos cuerpos a distinta temperatura se ponen en contacto se inicia un proceso de intercambio de calor que iguala sus temperaturas. Imagina que sumerges una barra de hierro al rojo vivo en un recipiente con agua a temperatura ambiente. Cuando pasa el tiempo, la temperatura final del agua habrá subido, y la de la barra de hierro habrá bajado, pero ambas son iguales: han llegado al equilibrio térmico.
Se dice que dos cuerpo están en equilibrio térmico cuando están a la misma temperatura, y por tanto no intercambian calor. La ecuación de equilibrio térmico indica que el calor que absorbe un cuerpo es igual que el calor que cede el otro, es decir:
Donde:
- mA ,mB : Masas de los cuerpos A y B respectivamente. Es la cantidad de sustancia considerada de cada cuerpo. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- cA , cB : Calor específico del cuerpo A y del cuerpo B respectivamente. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC )
- Temperaturas TA, TB y T : Temperatura inicial del cuerpo A, del cuerpo B y temperatura final de equilibrio térmico respectivamente. Su unidad de medida en el Sistema Internacional es el Kelvin ( K )
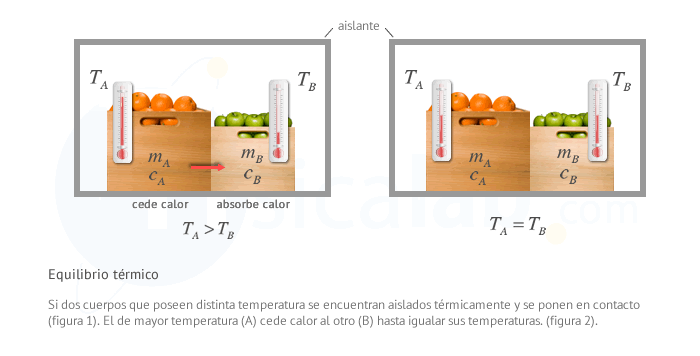
Comprobación
Un aislante térmico es un material que, idealmente, no intercambia calor con el entorno. Si ponemos en contacto en el interior de un aislante térmico dos cuerpos A y B a distintas temperaturas TA y TB con TA > TB , se comprueba empíricamente que las tempteraturas de ambos cuerpos tienden a igualarse si dejamos que pase el suficiente tiempo a una temperatura T. Esto sucede por que la temperatura es una variable de estado y las variables de estado tienen igual valor en todos los puntos del sistema (en este caso, el sistema formado por los dos cuerpos, completamente aislados del exterior). La variación de temperatura se produce debido a un intercambio de calor entre ambos cuerpos de manera que el calor que absorbe el primero debe ser igual al calor que cede el segundo, quedando:
Propagación del calor
Existen 3 mecanismos por los cuales los cuerpos intercambian su energía térmica: Conducción, convección y radiacion. Vamos a estudiarlos.
Conducción
En la conducción dos cuerpos que se encuentran directamente en contacto (o partes de un mismo cuerpo a distinta temperatura) intercambian energía sin que exista transporte de materia. Se basa en la transferencia directa de energía cinética a escala molecular. Cada sustancia tiene un valor asociado de conductividad térmica que indica la rapidez con que es capaz de transferir la energía. Su unidad de medida en el Sistema Internacional es el watio por metro y por grado kelvin ( W·m-1·K-1 ). Las sustancias pueden ser:
- Buenos conductores térmicos: Poseen una alta conductividad
- Malos conductores térmicos: Poseen una baja conductividad
En el ejemplo anterior de equilibrio térmico, las dos cajas intercambian calor por conducción.

Convección
Se produce en líquidos y gases. En este caso si existe transporte de materia. El calor se propaga debido a unas corrientes denominadas corrientes de convección que se producen entre las distintas partes de la sustancia. Aquellas a mayor temperatura (por estar en contacto con la fuente de calor) disminuyen su densidad respecto a las más frías. Las partes menos densas (más calientes) se desplazan a las capas altas y las más densas (más frías) a las bajas. Al cabo del tiempo, se repite el proceso al enfriarse las capas superiores y calentarse las inferiores, dando lugar así a una corriente de convección. Este fenómeno se da, por ejemplo, cuando calentamos un agua en una olla.

Radiación
Se produce por la propagación de energía electromagnética a través del espacio. No es necesaria la presencia de materia. Por ejemplo, cuando el Sol calienta la Tierra, su energía recorre una gran distancia en el espacio vacío. El sol es un claro ejemplo de cuerpo que emite radiación electromagnética debido a su temperatura. Sin embargo todos los cuerpos, por el hecho de encontrarse a cierta temperatura, emiten radiación térmica. Dicha radiación es de naturaleza electromagnética y, en el caso de los cuerpos muy calientes, como el sol, está dentro del rango de luz visible. Para otros objetos la radiación es invisible a nuestros ojos.

Y ahora... ¡Ponte a prueba!
Apartados relacionados
El apartado no se encuentra disponible en otros niveles educativos.
