Primera Ley de la Termodinámica
La primera ley de la termodinámica relaciona el trabajo y el calor transferido intercambiado en un sistema a través de una nueva variable termodinámica, la energía interna. Dicha energía ni se crea ni se destruye, sólo se transforma. En este apartado estudiaremos:
- Qué es la energía interna de un cuerpo
- El primer principio de la termodinámica
- El concepto de trabajo termodinámico
- Cómo extraer información útil de las gráficas presión - volumen
- Cuáles son los principales tipos de procesos termodinámicos
Energía interna
La energía interna de un sistema es una caracterización macroscópica de la energía microscópica de todas las partículas que lo componen. Un sistema está formado por gran cantidad de partículas en movimiento. Cada una de ellas posee:
- energía cinética, por el hecho de encontrarse a una determinada velocidad
- energía potencial gravitatoria, por el hecho de encontrarse en determinadas posiciones unas respecto de otras
- energía potencial elástica, por el hecho vibrar en el interior del sistema
Existen, además, otros tipos de energía asociadas a las partículas microscópicas tales como la energía química o la nuclear.
En definitiva, en el interior de un sistema conviven distintos tipos de energía, asociadas a las partículas microscópicas que los componen y que forman su energía interna.
En termodinámica la energía interna de un sistema ( U ) es una variable de estado. Representa la suma de todas las energías de las partículas microscópicas que componen el sistema. Su unidad de medida en el Sistema Internacional es el julio ( J ).
Observa que el valor de U es la suma de todas las energías del interior del sistema, por lo que no se incluye ni la energía cinética global ni la energía potencial gravitatoria global ni la energía potencial elástica global del mismo.
Energía interna en gases ideales
En los gases ideales, la energía interna se puede aproximar a la energía cinética media de las partículas que lo componen. La expresión que se recoge más abajo permite determinar su variación en un proceso cuyo volumen permanece constante (proceso isocórico).
La energía interna de un gas ideal depende únicamente de la temperatura que tenga el gas. La variación de energía interna que experimenta un gas al cambiar de temperatura viene dada por:
Donde:
- ∆U : Incremento de energía interna del gas ( ∆U = Ufinal - Uinicial ). Su unidad de medida en el Sistema Internacional es el julio ( J )
- m : Masa. Cantidad de gas considerada. Su unidad de medida en el Sistema Internacional es el kilogramo ( kg )
- cv : Calor específico a volumen constante. Representa la facilidad que el gas tiene para variar su temperatura cuando intercambia calor con el entorno. Su unidad de medida en el Sistema Internacional es el julio por kilogramo por kelvin ( J/kg·K ) aunque también se usa con frecuencia la caloría por gramo y por grado centígrado ( cal/g·ºC ). Cuando conocemos el número de moles de sustancia en lugar de su peso (nos dan m en moles), podemos usar el calor específico molar que se suele específicar en J/mol·K ó cal/g·ºC
- ∆T : Variación de temperatura. Viene determinada por la diferencia entre la temperatura inicial y la final ∆T = Tf -Ti . Su unidad de medida en el Sistema Internacional es el kelvín ( K ) aunque también se suele usar el grado centígrado o celsius ( ºC )
La expresión anterior nos da un método operativo para medir la variación de energía interna en un sistema gaseoso, proporcional al cambio de temperatura. Para llegar a ella aplicamos la primera ley de la termodinámica a un proceso a volumen constante (denominado isocórico) como podrás comprobar más abajo.
Primera ley de la termodinámica
La primera ley de la termodinámica establece una relación entre la energía interna del sistema y la energía que intercambia con el entorno en forma de calor o trabajo.
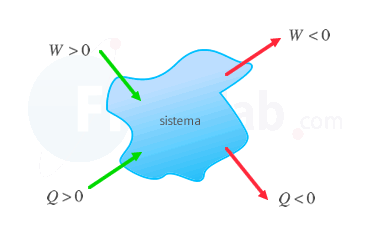
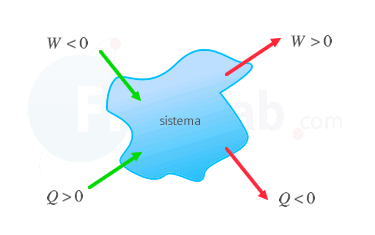
La primera ley de la termodinámica determina que la energía interna de un sistema aumenta cuando se le transfiere calor o se realiza un trabajo sobre él. Su expresión depende del criterio de signos para sistemas termodinámicos elegido:
|
Criterio IUPAC
Se considera positivo aquello que aumenta la energía interna del sistema, o lo que es lo mismo, el trabajo recibido o el calor absorbido. |
Criterio tradicional
Se considera positivo el calor absorbido y el trabajo que realiza el sistema sobre el entorno. |
Donde:
- ∆U : Incremento de energía interna del sistema ( ∆U = Ufinal - Uinicial ). Su unidad de medida en el Sistema Internacional es el julio ( J )
- Q : Calor intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J ), aunque también se suele usar la caloría ( cal ). 1 cal = 4.184 J
- W : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
Al igual que todos los principios de la termodinámica, el primer principio se basa en sistemas en equilibrio.
Por otro lado, es probable que hayas oído más de una vez que la energía ni se crea ni se destruye, solo se transforma. Se trata del principio general de conservación de la energía. Pues bien, la primera ley de la termodinámica es la aplicación a procesos térmicos de este principio. En un sistema aislado, en el que no se intercambia energía con el exterior, nos queda:
El universo en su totalidad se podría considerar un sistema aislado, y por tanto, su energía total permanece constante.
Finalmente observa que, al ser una función de estado, la diferencia de energía interna solo depende de los estados inicial y final, ∆U = Uf - Ui , y no del camino que haya seguido el proceso. El calor y el trabajo, en cambio, no son funciones de estado, por lo que sus valores dependen del caminio seguido por el proceso. Esto quedará bien ilustrado en los diagramas presión - volumen para gases ideales, como verás más abajo.
Trabajo termodinámico
La energía interna de un cuerpo no incluye la energía cinética global o potencial mecánica del mismo, tal y como señalamos anteriormente. Es por ello que no se ve alterada con el trabajo mecánico. En termodinámica nos interesa otro tipo de trabajo, capaz de variar la energía interna de los sistemas. Se trata del trabajo termodinámico.
Se denomina trabajo termodinámico a la transferencia de energía entre el sistema y el entorno por métodos que no dependen de la diferencia de temperaturas entre ambos. Es capaz de variar la energía interna del sistema.
Normalmente el trabajo termodinámico está asociado al movimiento de alguna parte del entorno, y resulta indiferente para su estudio si el sistema en sí está en movimiento o en reposo. Por ejemplo, cuando calientas un gas ideal en un recipiente con un pistón móvil en su parte superior, las partículas adquieren mayor energía cinética. Este aumento en la energía de las partículas se traduce en un aumento de la energía interna del sistema que, a su vez, puede traducirse en un desplazamiento del pistón. El estudio de este proceso desde el punto de vista de la termodinámica es independiente de si el sistema,como un todo, se encuentra en reposo o en movimiento, que sería una cuestión de mecánica. Sin embargo sí es cierto que, tal y como ocurre en una máquina de vapor, la energía de dicho trabajo termodinámico puede transformarse en energía mecánica.
Trabajo termodinámico presión - volumen
El trabajo termodinámico más habitual tiene lugar cuando un sistema se comprime o se expande y se denomina trabajo presión - volumen (p - v). En este nivel educativo estudiaremos su expresión en procesos isobáricos o isobaros, que son aquellos que se desarrollan a presión constante.
El trabajo presión - volumen realizado por un sistema que se comprime o se expande a presión constante viene dado por la expresión:
|
Criterio IUPAC
|
Criterio tradicional
|
Donde:
- Wsistema : Trabajo intercambiado por el sistema con el entorno. Su unidad de medida en el Sistema Internacional es el julio ( J )
- p : Presión. Su unidad de medida en el Sistema Internacional es el pascal ( Pa ) aunque también se suele usar la atmósfera ( atm ). 1 atm = 101325 Pa
- ∆V : Variación de volumen ( ∆V=Vf - Vi ). Su unidad de medida en el Sistema Internacional es metro cúbico ( m3 ) aunque también se suele usar el litro ( l o L ). 1 L = 1 dm3 = 10-3 m3
Presta atención al signo del trabajo, realizado por el sistema, en función del criterio de signos.
- Criterio IUPAC
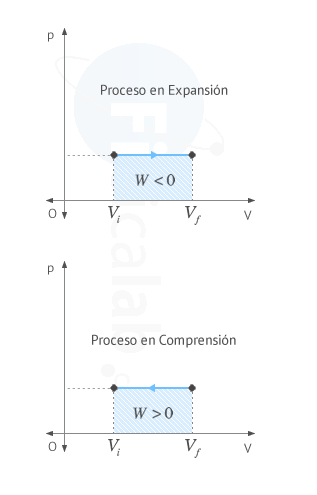
- Compresión Vi > Vf ⇒ Wsistema > 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema < 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
- Criterio tradicional
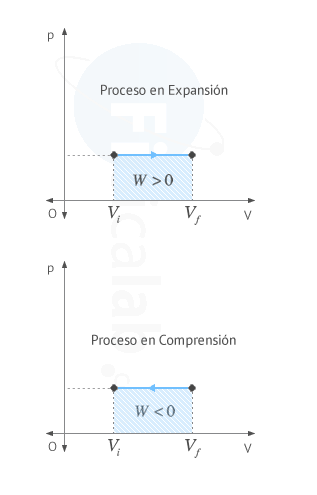
- Compresión Vi > Vf ⇒ Wsistema < 0 ⇒ El trabajo lo recibe el sistema del entorno ⇒ Aumenta la energía interna del sistema ⇒ ∆U > 0
- Expansión: Vi < Vf ⇒ Wsistema > 0 ⇒ El trabajo lo cede el sistema al entorno ⇒ Disminuye la energía interna del sistema ⇒ ∆U < 0
Gráficas presión - volumen
En el estudio del trabajo realizado por un sistema termodinámico con gases ideales es bastante común el uso de diagramas presión - volumen ( p - v ).
- Se representa el volumen V en el eje x
- Se representa la presión p en el eje y
- Se representa el proceso mediante una linea que une los puntos ( V ,p ) por los que este pasa entre el punto inicial ( Vi ,pi ) y el final ( Vf ,pf )
- Utilizaremos una flecha sobre la linea para indicar el sentido de la transformación termodinámica
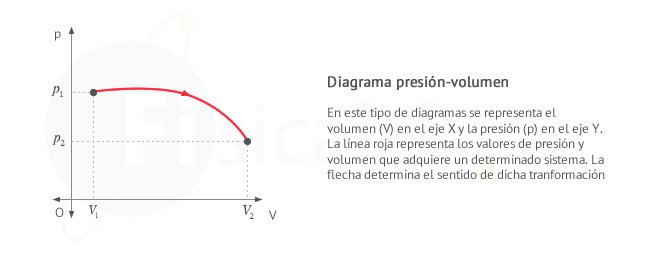
Las gráficas presión volumen nos sirven para calcular el trabajo realizado en un proceso en el que la presión no necesariamente tenga que ser constante.
El trabajo realizado por un sistema termodinámico coincide numéricamente con el area encerrada bajo la gráfica presión - volumen entre los valores de volumen inicial Vi y final Vf. El sentido de la flecha sobre la linea indica el signo del trabajo, según el criterio elegido
|
Criterio IUPAC
|
Criterio tradicional
|
|
|
|
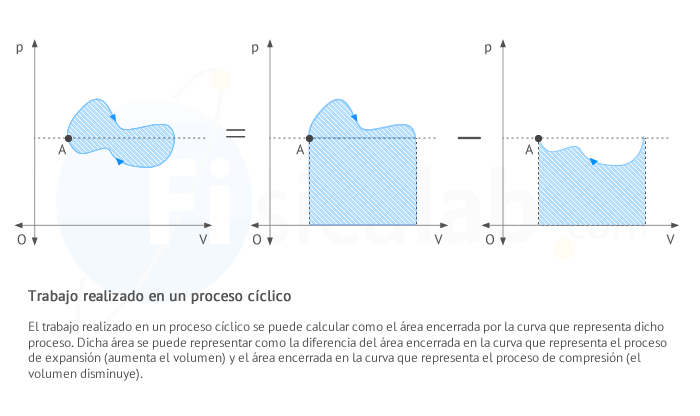
Observa que en un proceso cíclico el área encerrada por la curva se puede calcular como la resta entre el valor del área encerrada por la curva cuando el proceso se encuentra aumentando su volumen (en expansión) y el valor del área encerrada por la curva cuando el proceso se encuentra disminuyendo su volumen (en compresión), tal y como puede verse en la siguiente figura.
Interpretación de gráficas de gases ideales
Los diagramas presión volumen aportan gran cantidad de información, además de servir para el cálculo del trabajo realizado por el sistema. Vamos a particularizar en el caso de los gases ideales por ser su ecuación de estado
-
Cada punto de la gráfica marca un estado del sistema. Las variables de estado para una determinada cantidad de gas, son la presión, el volumen y la temperatura. Un punto en la gráfica p - v tiene una única temperatura asociada, según la expresión
-
Se puede demostrar que la energía interna U de un gas ideal depende únicamente de su temperatura. Así, a cada punto en la gráfica se le asocia, además de una temperatura, una energía interna.
-
Se denominan isotermas a las lineas que representan igual temperatura. Siguen la expresión
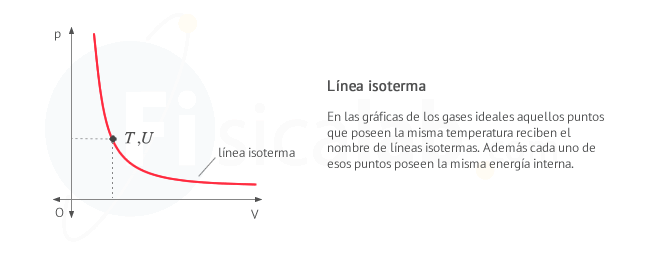
-
Trabajo y calor dependen, en general, del camino seguido para llegar a un punto a otro de la gráfica, de la transformación.
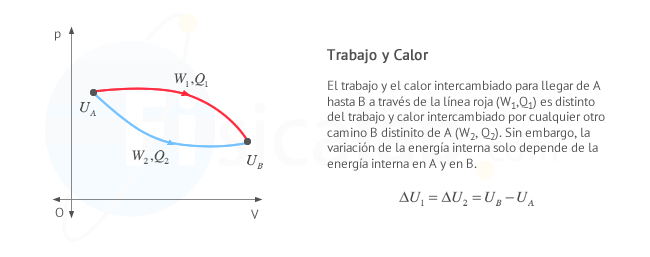
-
En un proceso cíclico, la temperatura inicial y final es la misma, por tanto la energía interna del sistema no varía

-
Para determinar el incremento de energía interna
El calor recibido por un gas a volumen constante viene dado por la expresión
Observa que, al depender el incremento de energía interna únicamente de los estados inicial y final (de la temperatura inicial y final), el valor obtenido será el mismo siempre que nos desplacemos a la misma isoterma, independientemente del camino seguido. Esto significa que, aunque el valor del incremento de energía se haya obtenido para un proceso a volumen constante, también será válido para cualquier proceso que se desplace a la misma isoterma. Puedes comprobarlo en este ejercicio.
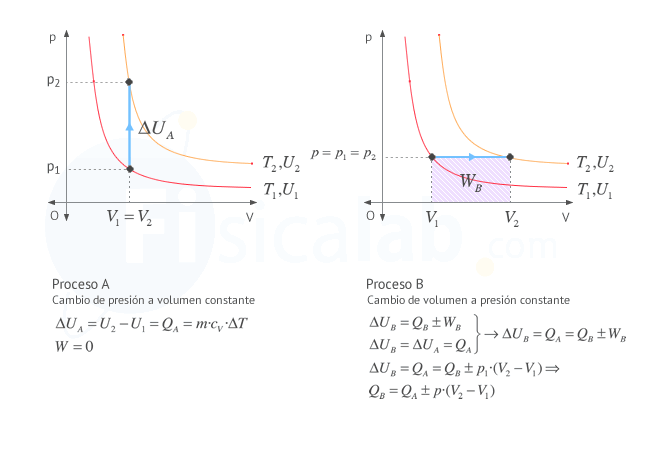
Como puedes observar en la figura si conocemos el incremento de energía interna en un proceso a volumen constante (proceso A), que experimentalmente es sencillo de determinar, se puede aplicar la primera ley de la termodinámica para conocer el trabajo el calor de otro proceso (proceso B) que termine en el mismo estado, o lo que es lo mismo, en la misma línea isoterma.
Tipos de procesos
Los procesos termodinámicos se suelen clasificar en:
-
Q = 0 Procesos adiabáticos. Aquellos en los que el sistema no intercambia calor. Por ejemplo, al usar un ambientador o desodorante en aerosol se produce un proceso casi adiabático. En estos casos
-
V = cte. Procesos isocóricos. Aquellos en los que el volumen permanece constante. Por ejemplo, una botella de champán metida en un recipiente con hielo. Al no haber variación de volumen, el trabajo del sistema es cero.
-
p = cte. Procesos isobáricos. Aquellos en los que la presión permanece constante. Por ejemplo, las reacciones químicas. El valor del trabajo se calcula a partir de la expresión
Por otro lado, este tipo de procesos permiten definir una nueva variable de estado, la entalpía H. De manera que:
Donde, como ves, la expresión de la entalpía no depende del criterio de signos seguido para llegar a ella
-
T = cte. Procesos isotérmicos. Aquellos en los que la temperatura permanece constante. Por ejemplo, un recipiente con gas y un pistón en la zona superior, sumergido en un depósito calorífico a temperatura constante. Al ser la temperatura constante, la variación de energía interna es cero
Donde se han tenido en cuenta los dos criterios de signos posibles. Observa que el proceso se realiza sobre una única isoterma:
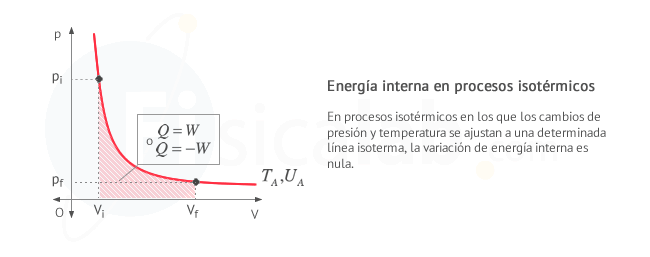
Y ahora... ¡Ponte a prueba!
Apartados relacionados
El apartado no se encuentra disponible en otros niveles educativos.